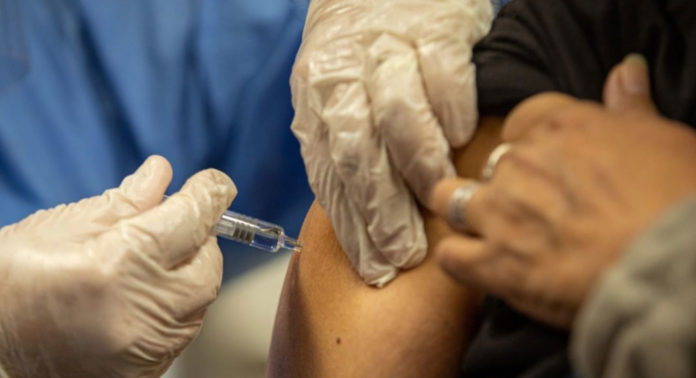
Este lunes comenzaron las pruebas de la vacuna elaborada por la compañía estadounidense Pfizer y su par alemana BioNTech en Argentina. Desde el Hospital Militar, los ensayos son coordinados por el equipo del doctor Fernando Polack, director de la Fundación Infant y médico especializado en virus respiratorios. En esta instancia, se espera que los equipos de especialistas comprueben la eficacia de la fórmula. Según los ensayos preliminares realizados en EE.UU. y Alemania, la vacuna candidata permite desarrollar un nivel alto de anticuerpos, tanto como los de los enfermos que se lograron recuperar.
La convocatoria se abrió y en poco tiempo ya había cerrado. Según señaló Sergio Maldonado, el director del Hospital, “se anotaron 25 mil pero solo participarán 4500 de esta instancia”. La muestra será variada e incluirá a personas con diferentes perfiles: médicos, enfermeros y otros profesionales de la salud, personas jóvenes y adultos mayores, militares y también individuos con otras profesiones. Los datos personales de todos los postulantes, según las autoridades del Hospital, serán resguardados. La mitad recibirá la vacuna, mientras que la mitad restante tendrá placebo (en forma de inyección de solución fisiológica). El propósito de contar con un grupo control radica en que es la única manera de supervisar si el fármaco realmente funciona.
El ensayo podrá ser abandonado por cualquier postulante en cualquier etapa del proceso. Ésta constituye una cláusula fundamental que, en general, incluye a cualquier prueba de vacuna y en este caso no supone una excepción.
Los voluntarios recibirán dos dosis, la primera en estos días y la segunda luego de tres semanas. Durante el procedimiento, los equipos de la Fundación Infant y del Hospital Militar estarán en constante diálogo con ellos, a través de llamadas telefónicas y de una aplicación creada a tales efectos. El propósito será realizar un seguimiento para ir advirtiendo posibles efectos adversos y sus síntomas, aunque la vacuna ya atravesó con éxito las fases 1 y 2 que evalúan esas respuestas secundarias que el cuerpo podría manifestar. En una primera etapa, el fármaco sorteó el examen de seguridad y toxicidad en Alemania y Estados Unidos, con lo cual recibió la aprobación de la FDA (Food and Drugs Administration, institución equivalente a la Anmat pero en Estados Unidos) para avanzar hacia las siguientes fases. En aquella oportunidad fue suministrada a 45 adultos (entre 18 y 55 años) que recibieron dosis distintas entre sí (10, 30 y 100 mg) y a nueve de ellos les tocó placebo. Las personas que se sometieron a las pruebas desarrollaron una cantidad de anticuerpos que superan a los que presentaron los pacientes recuperados de la covid-19. Los expertos señalaron que “fue bien tolerada”, aunque en algunos casos generó fiebre y otros daños colaterales menores.
En Argentina, la meta será convertir un experimento chiquito en uno de dimensiones mucho más importantes. Luego, el paso siguiente para las compañías biotecnológicas será fabricar 100 millones de dosis y, para el año que viene, 1200 millones. El trabajo, finalmente, tendrá que someterse a la lupa de los colegas y, para obtener mayor fuerza, ser publicado en alguna revista médica de prestigio internacional.
Cuando la vacuna esté finalmente lista y si esta versión que se probará a nivel local obtiene buenos resultados, el país podrá colocarse en un lugar de preferencia al momento de disputar el acceso a las dosis necesarias. Se espera que obtenga algunas ventajas en los procesos de compra y distribución, aspecto que entusiasma a las autoridades de Salud. La cartera abocada al área representada por Ginés González García mantiene conversaciones periódicas con otras empresas biotecnológicas del rubro que también manifestaron su interés por probar su fármaco en arenas domésticas.
Sus características
Cuando se diseña una vacuna lo primero que hay que pensar es en qué necesitan los pacientes. En este caso, son defensas para que reaccionen ante un microorganismo específico como es el Sars CoV-2. En base a ello, se selecciona el tipo que se fabricará. Hay muchas estrategias disponibles y muchas vacunas candidatas (la OMS ha reconocido nada menos que 165): algunas utilizan al virus inactivado –como la hepatitis A–, otras emplean al virus atenuado –como la Sabin–, unas actúan sobre el ARN viral, o bien, están las que solo incorporan una proteína –en este caso la “S”, Spike, puerta de entrada al coronavirus–. La de Pfizer y BioNTech, precisamente, emplea la tecnología de ARN. Ello prevé una mala y una buena noticia. La mala es que no es una técnica muy probada a nivel internacional, de hecho, no existe ninguna de este tipo en el calendario obligatorio. La buena es que se trata de una opción muy interesante porque se puede escalar industrialmente a una gran velocidad.
La vacuna utiliza moléculas de ARN que tienen el código para la síntesis de la proteína viral. Están recubiertas (por una vesícula) y son inyectadas. Se supone que, si todo funciona como debería, cuando llegan a las células del organismo, los genes que están en el ARN se expresan y se generan los anticuerpos. De esta manera podrían permanecer y proteger a los seres humanos ante una futura infección.
Fuente: www.pagina12.com.ar